බොයිල් නියමය
මෙම ලිපිය වනාහි Boyle's law ලිපියෙහි ඉංග්රීසි භාෂාවේ සිට සිංහල වෙත නොනිමි පරිවර්තනයකි . ඉංග්රීසි සහ සිංහල යන භාෂාවන්හි සුදුසු හා ප්රමාණවත් පරිචයක් ඇත්නම්, මෙම පරිවර්තනය සම්පූර්ණ කිරීමට ඔබට අවකාශ ඇත. අදාල විෂය පිලිබඳ දැනුවත්නම්, නැවුම් ස්වයං නිර්මාණයක් ලෙස ලිපිය සම්පූර්ණ කිරීමට ඔබට අවකාශ ඇත. |
බොයිල් නියමය හෙවත් බොයිල් - මැරියට් නියමය වායු නියමයන්ගෙන් එකක් වන අතර උෂ්ණත්වය හා මවුල සංඛ්යාව නියත වූ සංවෘත පද්ධතියක් තුළ පීඩනයේ හා පරිමාවේ ගුණිතය නියතයක් බව ප්රකාශ කෙරෙන පරිපූර්ණ වායු නියමයට මූලික පදනම විය. තවද පරිපූර්ණ වායු නියමයට අනුව පීඩනය හා පරිමාව එකිනෙකට ප්රතිලෝමව සමානුපාතික වේ. මෙම නියමය 1662 දී මුලින්ම ප්රකාශයට පත් කරන ලද රසායන හා භෞතික විද්යාඥයකු රොබට් බොයිල්ගේ නමින් නම් කරන ලදී. නියමය සංක්ෂිප්තව හා නිවැරදිව පහත පරිදි ප්රකාශ කළ හැක.
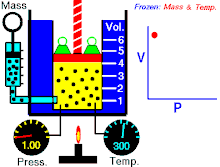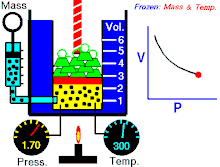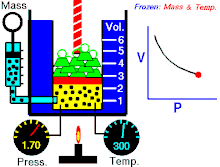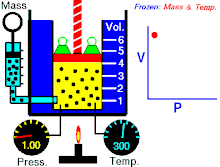
නියත උෂ්ණත්වයේ පවතින නියත වායු ප්රමාණයක් සදහා P හා V එකිනෙකට ප්රතිලෝමව සමානුපාතික වේ. (එනම් පීඩනය වැඩිවේ නම් පරිමාව අඩුවේ. නැතහොත් පීඩනය අඩුවේ පරිමාව වැඩි වේ)
ඉතිහාසය
සංස්කරණය1662 වසරේදී අයර්ලන්ත ජාතික ස්වභාව විද්යාඥ රොබට් බොයිල් විසින් මුල්වරට ප්රකාශයට පත් කරන ලද වායු නියමය බොයිල් නියමය ලෙස හදුන්වනු ලැබේ. බොයිල්ගේ මිතුරන් දෙදෙනෙකු හා ආධුනික විද්යාඥයන් වූ රිචඩ් ටොවුන්ලි හා නැන්රි පවර් විසින් මෙම නියමයට පදනම් වූ පරිමාව හා පීඩනය අතර සම්බන්ධතාවය සොයාගෙන එයවෙත බොයිල්ගේ අවධානය යොමු කරවන ලදී. බොයිල් ඔවුන් අනුව යමින් ක්රමානුකූල පරීක්ෂණ ඔස්සේ නියමයේ සදහන් කරුණු තහවුරු කරගත් අතර අනතුරුව ඔහු සිය පරීක්ෂණවල ප්රතිඵල ප්රකාශයට පත් කරන ලදී. කෙසේ නමුත් මෙම පරීක්ෂණය සදහා බොයිල්ගේ සහයකයා වූ රොබට් හුක් විශාල දායකත්වයක් දරන්නට ඇති බව රොබට් හුක් බොයිල්ට වඩා දක්ෂ ගණිතඥයෙකු වූ අතර බොයිල්ගේ පරීක්ෂණ උපකරණවල නිර්මාපකයා ද විය. හෙතෙම පරීක්ෂණයට අවශ්ය වූ වඩාත් ක්රියාකාරී හා කාර්යක්ෂම රික්ත පොම්පද නිර්මාණය කළේය. 1676 වර්ෂයේදී බොයිල්ගෙන් පරිබාහිරව එඩ්මේ මැරියට් නම් ප්රංශ ජාතික භෞතික විද්යාඥයා ද එම වායු නියමයම සනාථ කර ප්රකාශයට පත් කළේය. එබැවින් බොයිල් නියමය බොයිල් - මැරියට් නියමය හෝ මැරියට් නියමය ලෙස ද හැඳින්විය හැක.
නිර්වචනය
සංස්කරණයචාලක වාදය හා පරිපූර්ණ වායු සමග බොයිල් නියමයේ සම්බන්ධතාවය
සංස්කරණයබොයිල් නියමය වායු නියම 23 අතුරින් වඩාත් මූලිකම එක වන අතර එමඟින් කියැවෙන්නේ නියත උෂ්ණත්වයේ දී වායුවක පීඩනය අඩු කරන විට පරිමාව වැඩි වන බවයි. බොයිල් නියමය හඳුන්වාදුන් කාලයේ වූ තාක්ෂණික මෙවලම් මඟින් මෙම නියමයට අනුකූල නොවන හැසිරීම් නිරීක්ෂණය කළ නොහැකි වූ නමුත් වර්තමානයේ ඔහුගේ නියමයේ සීමාවන් පැහැදිලිව නිරීක්ෂණය කළ හැකි බැවින් බොයිල් නියමය පරිපූර්ණ වායු සදහා පමණක් පූර්ණව වලංගු වන බව පැහැදිලි කර ඇත. පරිපූර්ණ වායුවක් සමන්විත වනුයේ එකිනෙකින් ස්වායත්තව චලනය වන කුඩා අණු රැසකින් වන අතර බොයිල් සිය නියමය සදහා උපකල්පනය කරන ලද තත්වය ද එයම විය.
1738 වසරේදී ඩැනියල් බර්නූලි අණුක තත්වයේ හැසිරීම්වලට නිව්ටන් නියම යෙදීම මඟින් බොයිල්ගේ නියමය ව්යුත්පන්න කිරීමට සමත් විය. නමුත් ඔහුගේ සොයාගැනීම් 1845 වර්ෂයේදී ජෝන් වෝටර්ස්ටන් විසින් චාලක වාදයේ මූලික සංකල්ප අයත් නිබන්ධනයක් පළ කරන තෙක් නොසලකා හැරීමට ලක්විය. එවිට ද එංගලන්ත රාජකීය සංගමය වෝටර්ස්ටන්ගේ සොයාගැනීම් ප්රතික්ෂේප කළ අතර පසු කලෙක ජේම්ස් ප්රෙස්කොට් ජූල් , රුඩොල්ෆ් ක්ලෝසියස් හා ලඩ්විග් බෝල්ට්ස්මාන් වායු පිළිබද චාලකවාදය සනාථ කරමින් බර්නූලිගේ හා වෝටර්යන්ගේ මතයක් ස්ථිර කරන තෙක් රාජකීය සංගමය ඔවුන් ප්රතික්ෂේප කර තිබුණි.
ශක්තිවාදයේ (Energetic) හා පරමාණුකවාදයේ (Atomism) අනුගාමිකයන් අතර විවාදයක් නිසා 1898 වර්ෂයේ දී බෝල්ට්ස්මාන් පල කරන ලද ග්රන්ථය 1901 වර්ෂයේ ඔහු සියදිවි හානි කරගන්නා තෙක්ම විවේචනයට භාජනය විය. නමුත් 1905 වර්ෂයේ දී ඇල්බට් අයින්ස්ටයින් ද්රවයක් තුළ අවලම්භිත අංශුවක බ්රවුනීය චලිතය පැහැදිලි කිරීමට චාලකවාදය යොදාගත හැකි බව පෙන්වා දුන් අතර 1908 වසරේ දී ජීන් පෙරින් මේ බව සනාථ කරන ලදී. මේ අනුව බල කළ බොයිල් නියමය චාලකවාදය මගින් ව්යුත්පන්න කළ හැකි බව පැහැදිලි වේ.
සමීකරණය
සංස්කරණයබොයිල් නියමයේ ගණිතමය ප්රකාශනය පහත පරිදි වේ.
- මෙහි
- p = පද්ධතියේ පීඩනය
- V = වායුවේ පරිමාව
- k = පරිමාව හා පීඩනයට අදාල නියතයකි
මෙහිදී උෂ්ණත්වය හා ස්කන්ධ යන දෙකම නියත් විට P1V1 = P2V2 සමීකරණය යෙදිය හැකිය..
දෙන ලද පද්ධතියක උෂ්ණත්වය නියතව තිබෙන තාක් එයට සැපයෙන ශක්තිය නියත බැවින් k හි අගය නියතව පවතිනු ඇත. නමුත් පද්ධතියේ සිදුවන අන්තර් අණුක ගැටීම් සහ පීඩනය සැලකීමේදී පෘෂ්ඨයක් මත අභිලම්භ බලය සැලකීම වැනි කරුණු හේතුවෙන් k අගය කුඩා සීමාවක් තුළ දෙන ලද කාල සීමාවක දී විචලනය විය හැක.
වායුවේ පරිමාව වැඩි කරන විට පද්ධතිය නියත උෂ්ණත්වයක පත්වාගන්නේ නම් වායුවේ පීඩනය අනුරූපව අඩුවිය යුතුවේ. මෙහි පරස්පරය ද සත්ය වේ.
බොයිල් නියමය යොදා ගැනෙන්නේ ආරම්භක නියත වායු ප්රමාණයක පීඩනය හා පරිමාව යන රාශි 2ම හෝ ඉන් එකක් පමණක් හෝ විචලනය කළ විට ලැබෙන ඵලය ගැන අනාවැකි පල කිරීමටයි. මෙහිදී ආරම්භක හා අවසාන උෂ්ණත්ව එකම වන විට (මෙම තත්වය පවත්වා ගැනීමට පද්ධති උණුසුම් හෝ සිසිල් කිරීමට සිදුවනු ඇත) ආරම්භක හා අවසාන පීඩන හා පරිමා අතර සම්බන්ධය නියමය මඟින් ලබාදේ.
බොයිල් නියමය චාල්ස් නියමය හා ගේලුසැක් නියමය එක්කර සංයුක්ත වායු නියමය නිර්මාණය කර ඇති අතර එම වායු නියමයන් තුන ඇවගාඩ්රෝ නියමය හා එක් කිරීමෙන් පරිපූර්ණ වායු නියමය ලැබේ.