පරමාණුක ස්කන්ධය
පරමාණුක ස්කන්ධය (m0) යනු එක් පරමාණුවක මුළු ස්කන්ධය වන අතර, එය බොහෝ විට පරමාණුක ස්කන්ධ ඒකක මගින් ප්රකාශ කරනු ලැබේ. පරමාණුක ස්කන්ධය යනු උදාසීන පරමාණුවක ප්රෝටෝන , නියුට්රෝන හා ඉලෙක්ට්රෝනවල ස්කන්ධයේ එකතුවය. ඇතැම් අවස්ථාවලදී පරමාණුක ස්කන්ධය සාපේක්ෂ පරමාණුක ස්කන්ධය , සාමාන්ය පරමාණුක ස්කන්ධය , පරමාණුක බර ආදී වචන සදහා සමාන පදයක් ලෙස භාවිතා වූවද , එය වැරදි සහගත වේ. මෙහිදී එක් අවස්ථාවක දී පරමාණුවක තිබිය හැක්කේ එක් සමස්ථානිකයක් පමණක් වන අතර, එය බහුතරයකගේ සාමාන්යය අගය නොවේ. බොහෝ මූලද්රව්යවල එක් ප්රධාන සමස්ථානිකයක් පවතින අතර, එවිට එම සමස්ථානිකයේ ස්කන්ධය හා සාපේක්ෂ පරමාණුක ස්කන්ධය අතර ඇත්තේ ඉතා සුළු වෙනසකි. එවිට එය නොගිනිය හැකි වුවත් , ඒක පරමාණුක වශයෙන් ගත් කළ එහි සැලකිය යුතු වෙනසක් සිදුවේ. එක් ප්රධාන සමස්ථානිකයකට වඩා පවතින මූලද්රව්යවල මෙම වෙනස පැහැදිලිව දැකගත හැක. (උදා : ක්ලෝරීන්) දුර්ලභ සමස්ථානිකවල මෙම වෙනස ඒකක කීපයක් විය හැක. සාපේක්ෂ පරමාණුක ස්කන්ධය (Ar) (පරමාණුක භාරය/ සාමාන්ය පරමාණුක ස්කන්ධය) සියලුම මූලද්රව්ය සමස්ථානිකයන්ගේ ස්කන්ධයේ සාමාන්ය අගය වන අතර, ඒ සදහා සාපේක්ෂ සමස්ථානික සුලභතාව ද බලපා ඇත. මෙය බොහෝ විට සම්මත පරමාණුක භාරයට සමාන අර්ථය ලබා දේ. සාපේක්ෂ පරමාණුක ස්කන්ධය භෞමික හා අභෞමික් පරිසරයටද එකසේ යොදාගත හැකිය.
| Atomic mass | |
|---|---|
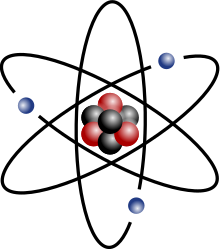 Stylized lithium-7 atom: 3 protons, 4 neutrons, and 3 electrons (total electrons are ~1⁄4300th of the mass of the nucleus). It has a mass of 7.016 Da. Rare lithium-6 (mass of 6.015 Da) has only 3 neutrons, reducing the atomic weight (average) of lithium to 6.941. | |
Common symbols | ma, m |
| SI unit | kilogram (kg) |
Other units | dalton (Da) |
| Intensive? | yes |
Behaviour under coord transformation | scalar |
IUPAC කමිටුවේ පරමාණුක භාර හා සමස්ථානික සුලභත්වය පිළිබද පනතෙන් සම්මත පරමාණුක භාරය , පෘථිවි පෘෂ්ඨය මත ඕනෑම පරිසරයක මූලද්රව්යයක සාපේක්ෂ පරමාණුක ස්කන්ධයට සමාන බව සදහන්ව ඇත. මෙය ආවර්තිතා වගුවේ මූලද්රව්යවල සම්පූර්ණ බර ගණනයට යොදාගෙන ඇත. මෙහිදී නිවැරදිව ගණනය කිරීමට අපහසු බර, සාමාන්යය අගයක් වශයෙන් වරහන් තුළ අන්තර්ගතව ඇත. කෘත්රීම මූලද්රව්යවල වඩාත්ම ස්ථායී සමස්ථානිකයේ (එනම් දීර්ඝතම අර්ධ ආයු කාලය ඇති සමස්ථානිකයේ) මුළු නියුක්ලියෝන ගණන වරහන් තුළ යොදා සම්මත පරමාණුක ස්කන්ධය සදහන් විය යුතු ස්ථානයේ සදහන් කරයි. ලිතියම් මූලද්රව්යය මෙහිදී අද්විතීය කාර්යක් ඉටු කරයි. එයට හේතුව එහි සම්මත පරමාණුක භාරයේ අවිනිශ්චිතභාවය පිරික්සීම උදෙසා ලිතියම්හි ස්වාභාවික සමස්ථානිකවල සුලභත්වය මිනිස් ක්රියාකාරකම් මගින් කැළඹීමකට ලක්වීමයි.
සාපේක්ෂ සමස්ථානික ස්කන්ධය මනිනු ලැබ ඇත්තේ කාබන් - 12 පරමාණුවේ ස්කන්ධය 12 ලෙස ගැනීමෙනි. බන්ධන ශක්තියේ වෙනස් වීම් හා නියුට්රෝන , ප්රෝටෝන වෙනස්වීම හේතුවෙන් අනෙකුත් කිසිදු මුලද්රව්ය සමස්ථානිකයක එසේ පූර්ණ සංඛ්යාවක් නොපවතී. කෙසේ වුවත් බන්ධන ශක්තිය හේතුවෙන් ඇති වන ස්කන්ධ හානිය, නියුක්ලියෝනයක ස්කන්ධයට සාපේක්ෂව අවම වන නිසා, සමස්ථානිකයක පරමාණුක ස්කන්ධය ඔබට පවසනුයේ මුළු නියුක්ලියෝන ගණනයි. එවිට නියුට්රෝන ගණන, මුළු නියුක්ලියෝන ගණනින් පරමාණුක ක්රමාංකය අඩු කිරීම මගින් සොයාගත හැක.'සපේක්ෂ පරමාණුක ස්කන්ධය ' යන සංකල්පය පැහැදිලි ලෙස අවබෝධ කරගැනීමට කැනිට්සාරෝගේ හැදෑරීම ප්රයෝජනවත් වේ.