ජලයේ රසායනික සහ භෞතික ගුණ
ජලය දැනට සොයාගෙන ඇති සියළු ජීවී ආකාරවලට අත්යාවශ්ය ද්රාවකයක් වන අතරම පෘථිවිය මතුපිට බහුලව පවතින සංයෝගයක් ද වේ.

| |||
| |||

| |||
| Names | |||
|---|---|---|---|
| IUPAC name
Water
| |||
| Systematic IUPAC name
Oxidane | |||
වෙනත් නාම
| |||
| Identifiers | |||
| CAS number | {{{value}}} | ||
3D model (JSmol)
|
|||
| 3587155 | |||
| ChEBI | CHEBI:{{{value}}} | ||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| EC Number |
| ||
| 117 | |||
| KEGG | {{{value}}} | ||
| PubChem | {{{value}}} | ||
| RTECS number | {{{value}}} | ||
| UNII | |||
| InChI | |||
| SMILES | |||
| Properties | |||
| Molecular formula | H2O | ||
| අණුක ස්කන්ධය | 18.01528(33) g/mol | ||
| Appearance | Almost colorless or white crystalline solid, almost colorless liquid, with a hint of blue, colorless gas[3] | ||
| Odor | Odorless | ||
| Density | |||
| Melting point |
0.00 °C, 273 K, 32 °F | ||
| Boiling point |
99.98 °C, 373 K, 212 °F | ||
| Solubility | Poorly soluble in haloalkanes, aliphatic and aromatic hydrocarbons, ethers.[8] Improved solubility in carboxylates, alcohols, ketones, amines. Miscible with methanol, ethanol, propanol, isopropanol, acetone, glycerol, 1,4-dioxane, tetrahydrofuran, sulfolane, acetaldehyde, dimethylformamide, dimethoxyethane, dimethyl sulfoxide, acetonitrile. Partially miscible with diethyl ether, methyl ethyl ketone, dichloromethane, ethyl acetate, bromine. | ||
| Vapor pressure | 3.1690 කිලෝpascals or 0.031276 atm at 25 °C[9] | ||
| Acidity (pKa) | 13.995[10][11][a] | ||
| Basicity (pKb) | 13.995 | ||
| Thermal conductivity | 0.6065 W/(m·K)[4] | ||
| Solubility product, Ksp | 1.3330 (20 °C)[14] | ||
| Viscosity | 0.890 mPa·s (0.890 cP)[15] | ||
| Structure | |||
| Crystal structure | Hexagonal | ||
| Molecular shape | Bent | ||
| 1.8546 D[16] | |||
| Thermochemistry | |||
| Std enthalpy of formation ΔfH |
−285.83 ± 0.04 kJ/mol[8][17] | ||
Std molar
entropy (S⦵298) |
69.95 ± 0.03 J/(mol·K)[17] | ||
Heat capacity (C)
|
75.385 ± 0.05 J/(mol·K)[17] | ||
| Hazards | |||
| Occupational safety and health (OHS/OSH): | |||
Main hazards
|
Drowning Avalanche (as snow) Water intoxication | ||
| Flash point | {{{value}}} | ||
| Safety data sheet (SDS) | SDS | ||
| Related compounds | |||
| Other cations | |||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |||



තොරතුරු හා ගුණාංග
සාමාන්ය නම ජලය
IUPAC නම ඔක්සිඩේන්
අමතර නම් ඇක්වා , ඩයි හයිඩ්රජන් මොතොක්සයිඩ්
හයිඩ්රජන් හයිඩ්රොක්සයිඩ්
අණුක සූත්රය H2O
CAS අංකය 7732-18-5
InChI InChI = 1/ H2O / hIH2
අණුක ස්කන්ධය 18.0153 gmol-1
ඝනත්වය හා කලාපය 0.998gcm-3 (200°C හිදී 1atm හිදී ද්රව තත්වයේ වේ)
0.917gcm-3 (00°C හිදී 1atm හිදී ඝන තත්වයේ වේ)
ද්රවාංකය 00°C (273.15K) (320F)
තාපාංකය 99.974°0C (373.124K) (211.950F)
විශිෂ්ට තාප ධාරිතාවය 4.184Jg-1K-1 (200°C හිදී ද්රව අවස්ථාවේ දී)
ජලයේ අණුක සූත්රය “H2O” වන අතර එක් ජල අණුවක් සමන්විත වන්නේ එක් ඔක්සිජන් පරමාණුවක් හා සහසංයුජව බන්ධනය වී ඇති හයිඩ්රජන් පරමාණු යුගලකිනි.
ජලයේ ප්රධාන භෞතික හා රසායනික ලක්ෂණ කිහිපයක් පහත දැක්වේ.
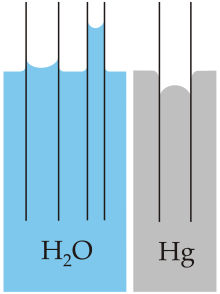
· ජලය කාමර උෂ්ණත්වයේ දී ද්රව තත්වයේ පවතින රසයකින් හා ගන්ධයකින් තොර ද්රව්යයකි. ජලය කුඩා පරිමාවක් ගත් කළ අවර්ණ ස්වභාවයක් පෙන්වුවද සහජයෙන්ම ජලය හා අයිස් ඉතා මද නිල් පැහැයකින් යුක්තය. අයිස් ද කුඩා ප්රමාණවලින් අවර්ණ ස්වභාවයක් පෙන්වන අතර ජල වාෂ්ප වායූන් මෙන් අදෘශ්යමාන වේ. · ජලජ ශාකවලට ජලයේ ජීවත්වීමට හැකිව ඇත්තේ ජලය පාරදෘශ්ය බැවින් හිරු එළිය එම ශාක වෙත ළගා වන බැවිනි. ප්රබල පාරජම්බුල (UV) තරංග පමණක් ජලය මගින් තරමක් දුරට අවශෝෂණය කරයි. · ජලය සම්මත තත්ව යටතේ ද්රව කලාපයේ පවතී. · ඔක්සිජන්හි විද්යුත් ඍණතාව හයිඩ්රජන්ට වඩා ඉහළ හෙයින් ජල අණු ධ්රැවීය වේ. ඒ අනුව ජල අණුවක හයිඩ්රජන් පරමාණු සුළු ධන ආරෝපණයක් ද ඔක්සිජන් පරමාණුව සුළු ඍණ ආරෝපණයක් ද දරණ හෙයින් අණුවට ඉහළ සඵල ද්වී ධ්රැව ඝූර්ණයක් ඇත. මේ හේතුවෙන් ජල අණු එකිනෙක අතර ඇති කරගන්නා ද්වි ධ්රැව - ද්වි ධ්රැව ආකර්ෂණ බල හේතුවෙන් ජලයට ප්රභල පෘෂ්ටීය ආතතියක් ඇත. · ජල අණු එකිනෙකට බැද තැබීමට වැදගත් වන තවත් බලයකි හයිඩ්රජන් බන්ධනය. · ජලයේ (සහ අනෙකුත් ද්රවවල) තාපාංකය වායු පීඩනය හා ඍජුව බැදී තිබේ. උදාහරණයක් ලෙස එවරස්ට් කන්ද මුදුනේ ජලය නටන උෂ්ණත්වය 680°C (1540F) වන අතර මුහුදු මට්ටමේ දී එය 100°C (212F) වේ. මෙහි පරස්පරදය ද සත්ය වන අතර එබැවින් සාගරයේ ඉතා ගැඹුරු ප්රදේශවල පිහිටි භූතාප කවුළු අවම ප්රදේශවලදී සෙල්සියස් අංශක සිය ගණනක උෂ්ණත්වයක් යටතේ ද ජලය ද්රව තත්වයේ පවතී. · ජල අණු සංයුක්ත බල මගින් එකිනෙක බැදී පවතින හෙයින් ජලයට අධික පෘෂ්ඨික ආතිත ශක්තියක් පවතී. මෙයට හේතුව ජල අණුවල ධ්රැවීය ස්වභාවයයි. මෙම දැඩි පෘෂ්ඨික ආතිත ශක්තිය නිසා ජල පෘෂ්ඨයක් මත කේශික තරංග පැතිර යා හැක. · ජලයේ ධ්රැවීය ගුණ හේතුවෙන් එයට ප්රභල ආසක්ත බල ද තිබේ. · කේශික සිදුරක් සහිත නලයක් ඔස්සේ ජල කදක් ඉහළ නැගීමේ සංසිද්ධිය කේශික උද්ගමනය නම් වේ. මෙයට ගුරුත්වයට එරෙහිව ක්රියා කළ හැක. · ජලය විශ්වීය ද්රාවකය ලෙස ද හැදින්වෙන අතර බොහෝ ද්රව්ය දිය කරගත හැකි ප්රභල ද්රාවකයකි. අම්ල , ක්ෂාර , ලවණ හා සීනි වර්ග ද මෙවන් ද්රව්යය සදහා උදාහරණ වේ. මේ හැරුණු විට සමහර වායූන් ද (විශේෂයෙන් ඔක්සිජන් හා කාබන් ඩයොක්සයිඩ් ද) ජලයේ ද්රවණය වේ. මේ සියලු සංයෝග “ජලකාමී” සංයෝග ලෙස නම් කෙරේ. ජලය සමග හොදින් මිශ්ර නොවන ද්රව්ය ( උදා - තෙල් හා මේද) “ජලභීතික” ද්රව්ය ලෙස හැදින්වේ. · සෛලයක ඇති සියලුම ප්රධාන සංඝටක (ප්රෝටීන , DNA සහ පොලිසැකරයිඩද) ජලයේ ද්රවිතව පවතී. · පිරිසිදු ජලය දුර්වල විද්යුත් සන්නායකයක් වන නමුත් ලුණු / සෝඩියම් ක්ලෝරයිඩ් වැනි අයනික සංයෝගයකින් ස්වල්පයක් ද්රවණය කළ විට විද්යුත් සන්නායකතාව බොහෝ වැඩි වේ. · ජල අණු අතර පවතින හයිඩ්රජන් බන්ධන හේතුවෙන් ජලයට සොයාගෙන ඇති සියලු ද්රව්ය අතුරින් ඉහළම වාෂ්පීකරණයේ ගුප්ත තාපය (40.65kJmol-1) පවතින අතර ජලයේ විශිෂ්ට තාප ධාරිතාව දෙවැනි වන්නේ ඇමෝනියාවලට (NH3 වලට) පමණි. මෙම ගුණයන් හේතුවෙන් පෘථිවි උෂ්ණත්වයේ විශාල විචලනයන්ට ස්වාරක්ෂකයට ක්රියා කරමින් පෘථිවියේ දේශගුණය පාලනය කිරීමට ජලයට හැකියාවක් ලැබී ඇත. · ජලය උපරිම ඝනත්වය ළගා වන්නේ 3.980°C (39.160F) ක උෂ්ණත්වයේ දී තවදුරටත් සිසිල් කළ විට ජලයේ ඝනත්වය ක්රමයෙන් අඩුවන අතර ඝන තත්වයට පත්වීමේදී 9% ක ප්රසාරණයක් පෙන්වයි. මේ හේතුවෙන් ඇතැම් අසාමාන්යය ලක්ෂණ නිරීක්ෂණය කළ හැක. උදාහරණයක් ලෙස අර්ධ ලෙස අයිස් බවට පත්වූ පොකුණක පතුලේ පවා ජලජ ජීවීන්ට ජීවත් විය හැක. ඊට හේතුව පොකුණේ පතුලේ ඇති ජලය 40C (390F) ආසන්න උෂ්ණත්වයක ද්රව තත්වයේ පැවතීමයි. · ජලය බොහෝ ද්රව සමග හොදින් මිශ්ර වේ. උදාහරණයක් ලෙස ජල එතනෝල් හා ඕනෑම අනුගතයකින් මිශ්ර කළ විට ලැබෙනුයේ තනි සමජාතීය මිශ්රණයකි. එහෙත් ජලය හා බොහෝ තෙල් වර්ග අමිශ්ර වන අතර ඉහළ සිට පහළට ඝනත්වය වැඩිවන පිළිවෙලට ස්ථිර වෙන්වීම , මිශ්ර කිරීමට උත්සාහ කළ විට සිදුවේ. තවද වායුවක් ලෙස ජල වාෂ්ප වාතය සමග සම්පූර්ණයෙන්ම මිශ්ර වේ. · ජලය වෙනත් බොහෝ ද්රාවක සමග ස්ථිර තාපාංක මිශ්රණ ලබා දේ.
මෙම රූප සටහනෙන් දැක්වෙන්නේ ජලය සමග දරුණු ලෙස ප්රතික්රියා කරන ද්රව්යය ප්රවාහනයේදී යොදාගන්නා ADR නම් ලේබලයකි.
සෝඩියම් , ලිතියම් , කැල්සියම් හා පොටෑසියම් වැනි ඇතැම් ද්රව්යය ජලය සමග ප්රභලව ප්රතික්රියා කරන අතර ගිනි ගන්නා සුළු හයිඩ්රජන්
අමතර අවධානයට
සංස්කරණය- Chemical bonding of water
- Dihydrogen monoxide parody
- Double distilled water
- Electromagnetic absorption by water
- Fluid dynamics
- Hard water
- Heavy water
- Hydrogen polyoxide
- Ice
- Optical properties of water and ice
- Steam
- Superheated water
- Viscosity#Water § Notes
- Water cluster
- Water (data page)
- Water dimer
- Water model
- Water thread experiment
පාදසටහන්
සංස්කරණයමූලාශ්ර
සංස්කරණයhttp://en.wikipedia.org/wiki/Water#Chemical_and_physical_properties
සටහන්
සංස්කරණය- ^ "naming molecular compounds". www.iun.edu. 24 September 2018 දින මුල් පිටපත වෙතින් සංරක්ෂණය කරන ලදී. සම්ප්රවේශය 1 October 2018.
Sometimes these compounds have generic or common names (e.g., H2O is "water") and they also have systematic names (e.g., H2O, dihydrogen monoxide).
- ^ "Definition of Hydrol". Definition of Hydrol. http://www.merriam-webster.com/dictionary/hydrol. ප්රතිෂ්ඨාපනය 21 April 2019.
- ^ උපුටාදැක්වීම් දෝෂය: අනීතික
<ref>ටැගය;Braun_1993_612නමැති ආශ්රේයන් සඳහා කිසිදු පෙළක් සපයා නොතිබුණි - ^ Ramires, Maria L. V.; Castro, Carlos A. Nieto de; Nagasaka, Yuchi; Nagashima, Akira; Assael, Marc J.; Wakeham, William A. (1995-05-01). "Standard Reference Data for the Thermal Conductivity of Water". Journal of Physical and Chemical Reference Data. 24 (3): 1377–1381. Bibcode:1995JPCRD..24.1377R. doi:10.1063/1.555963. ISSN 0047-2689.
- ^ a b c Tanaka, M; Girard, G; Davis, R; Peuto, A; Bignell, N (August 2001). "Recommended table for the density of water between 0 C and 40 C based on recent experimental reports". Metrologia. 38 (4): 301–309. doi:10.1088/0026-1394/38/4/3.
- ^ Lemmon, Eric W.; Bell, Ian H.; Huber, Marcia L.; McLinden, Mark O. "Thermophysical Properties of Fluid Systems". In Linstrom, P.J.; Mallard, W.G. (eds.). NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology. doi:10.18434/T4D303. 23 October 2023 දින පැවති මුල් පිටපත වෙතින් සංරක්ෂිත පිටපත. සම්ප්රවේශය 17 October 2023.
- ^ Lide 2003, Properties of Ice and Supercooled Water in Section 6.
- ^ a b Anatolievich, Kiper Ruslan. "Properties of substance: water". 2014-06-02 දින පැවති මුල් පිටපත වෙතින් සංරක්ෂිත පිටපත. සම්ප්රවේශය 2014-06-01.
- ^ Lide 2003, Vapor Pressure of Water From 0 to 370 °C in Sec. 6.
- ^ Lide 2003, Chapter 8: Dissociation Constants of Inorganic Acids and Bases.
- ^ Weingärtner et al. 2016, පිටු අංකය: 13.
- ^ "What is the pKa of Water". University of California, Davis. 2015-08-09. 2016-02-14 දින පැවති මුල් පිටපත වෙතින් සංරක්ෂිත පිටපත. සම්ප්රවේශය 2016-04-09.
- ^ Silverstein, Todd P.; Heller, Stephen T. (17 April 2017). "pKa Values in the Undergraduate Curriculum: What Is the Real pKa of Water?". Journal of Chemical Education. 94 (6): 690–695. Bibcode:2017JChEd..94..690S. doi:10.1021/acs.jchemed.6b00623.
- ^ Lide 2003, 8—Concentrative Properties of Aqueous Solutions: Density, Refractive Index, Freezing Point Depression, and Viscosity.
- ^ Lide 2003, 6.186.
- ^ Lide 2003, 9—Dipole Moments.
- ^ a b c සැකිල්ල:Nist
- ^ GHS: PubChem 962 සංරක්ෂණය කළ පිටපත 2023-07-28 at the Wayback Machine
භාහිර සබැඳි
සංස්කරණය- "Water Properties and Measurements". United States Geological Survey. May 2, 2016. සම්ප්රවේශය August 31, 2016.
- Release on the IAPWS Formulation 1995 for the Thermodynamic Properties of Ordinary Water Substance for General and Scientific Use (simpler formulation)
- Online calculator using the IAPWS Supplementary Release on Properties of Liquid Water at 0.1 MPa, September 2008
- Chaplin, Martin (2019). "Structure and Properties of Water in its Various States". Encyclopedia of Water. Wiley Online Library 2019. pp. 1–19. doi:10.1002/9781119300762.wsts0002. ISBN 9781119300755. S2CID 213738895.
- Calculation of vapor pressure, liquid density, dynamic liquid viscosity, and surface tension of water
- Water Density Calculator සංරක්ෂණය කළ පිටපත 2011-10-19 at the Wayback Machine
- Why does ice float in my drink?, NASA

