අයනික බන්ධන
අයනික බන්ධනයක් යනු ස්ථිති විද්යුත් ආකර්ෂණ යටතේ කැටායන සහ ඇනායන අතර ඇතිවිය හැකි රසායනික බන්ධන වර්ගයකි. එනම් ප්රතිවිරුද්ධ ලෙස ආරෝපිත අයන අතර ආකර්ෂණයෙන් සෑදෙන බන්ධනයක් වේ.

ලෝහ ඉලෙක්ට්රෝන එකක් හෝ කිහිපයක් මුදාහරිමින් ස්ථායී ඉලෙක්ට්රෝන වින්යාසයක් සහිත ධන ආරෝපිත අයන හෙවත් කැටායන සාදයි. මෙසේ ලෝහවලින් ඉවත් කරන ඉලෙක්ට්රෝන අලෝහවලට ඇතුළු වී ස්ථායී ඉලෙක්ට්රෝන වින්යාසයක් සහිත සෘණ ලෙස ආරෝපණය වූ අයනයන් අතර ඇතිවන ස්ථිති විද්යුත් ආකර්ශන බල හේතුවෙන් මෙම අයන එක්වීමෙන් ද බන්ධන සාදනු ලැබේ.
උදාහරණයක් ලෙස සාමාන්ය මේසලුණු හෙවත් සෝඩියම් ක්ලෝරයිඩ් සලකා බැලු විට, සෝඩියම් හා ක්ලෝරීන් එකතු වීමේදී සෑම සෝඩියම් පරමාණුවක්ම ඉලෙක්ට්රෝන එක බැගින් ඉවත් කරමින් කැටායන () සාදන අතර සෑම ක්ලෝරීන් පරමාණුවක්ම ඉලෙක්ට්රෝනය බැගින් ලබාගනිමින් ඇනායන () සාදයි. මෙසේ සෑදුණු අයන එකිනෙක සමග 1:1 අනුපාතයට ආකර්ෂණය වීමෙන් සෝඩියම් ක්ලෝරයිඩ් (NaCl) සාදනු ලැබේ.
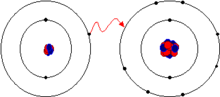
පරමාණුවලින් ඉලෙක්ට්රෝන ඉවත් වීම තාප අවශෝෂක ක්රියාවකි. මේ හේතුවෙන් අයන වැඩි ශක්තියක් ලබා ගනී. බන්ධන බිදීමේදීත් හෝ ඉලෙක්ට්රෝන එකකට වැඩි ප්රමාණයක් එක් කර ගනිමින් ඇනායන සෑදීමේදී ද ශක්ති විපර්යාස සිදුවිය හැකිය. කෙසේ වුවත් අයන එකිනෙකට ආකර්ෂණය වීමේදී ඒවා සතු ශක්තීන් මුක්ත කරයි.
නිදහස් පරමාණුවලට වඩා බැදුනු පරමාණුවල ශක්තිය අඩුවූ විට අයනික බන්ධන ඇති වනුයේ ප්රතික්රියාවේ සමස්ත ශක්ති විපර්යාසය වාසිදායක නම් පමණි. ශක්ති විපර්යාසය විශාලවත්ම සෑදෙන බන්ධනයේ ප්රබලතාවය ද වැඩිවේ. ලෝහවල විද්යුත් සෘණතාවය අඩුවීම හා අලෝහවල විද්යුත් සෘණතාව වැඩිවීම හේතුවෙන් ලෝහවලින් ඉලෙක්ට්රෝන පිටකරගන්නාවූ ද අලෝහ මගින් ඉලෙක්ට්රෝන ලබාගන්නා වූ ද ආකාරයේ ප්රතික්රියාවල ශක්ති වෙනස වඩාත් වාසිදායක වේ.
අයනික බන්ධන තනිව නොපවතී. සෑම අයනික බන්ධනයකම යම් ප්රමාණයක් සහසංයුජ හෝ ලෝහක බන්ධන පවතී. පරමාණු දෙක අතර විද්යුත් සෘණතා වෙනස විශාලවත්ම බන්ධනයේ අයනික ස්වභාවය ද වැඩිවේ. අයනික සංයෝග විලීන හෝ ද්රාවණ තත්වයන්හිදී විද්යුතය සන්නයනය කරයි. සාමාන්යයෙන් මෙවැනි සංයෝගවල ද්රවාංක ඉතා ඉහළ අතර ජලයේ ද්රාව්ය ලෙස පැවතීමට වැඩි නැඹුරුතාවයක් දක්වයි.
අයනික බන්ධන හා සහ සංයුජ බන්ධන අතර ඇති වෙනස්කම්
සංස්කරණයඅයනික බන්ධන ඇති වනුයේ ප්රතිවිරුද්ධ අයනවල ආකර්ෂණය හේතුවෙනි. නමුත් සහසංයුජ බන්ධන ඇති වනුයේ පරමාණු අතර ඉලෙක්ට්රෝන හවුලේ තබා ගැනීමෙනි. සහ සංයුජ බන්ධන ඇති විට පරමාණුවල අණුක ආකෘතිය VSEPR නියම අනුව නිර්ණය කර ඇත. නමුත් අයනික ද්රව්යවල ආකෘතිය සන්නිපාතක ආචරණය අනුව සැකසී ඇත.
විද්යුත් සන්නායකතාව
සංස්කරණයඅයනවලට නිදහසේ චලනය වෙමින් විද්යුත් ආරෝපණ ඇනෝඩයේ සිට කැතෝඩය වෙතට ගෙන යා හැකි බැවින් අයනික ද්රව්ය විද්යුතය සන්නයනය කරයි. මෙසේ අයනික ද්රව්ය විද්යුතය සන්නයනය කරනුයේ ඒවා විලීන තත්වයේ පවතින විටය. විලීන අවස්ථාවේ දී පරමාණු සචල වීමත් එවිට ඉලෙක්ට්රෝනවලට සෘජුවම අයනික ද්රව්ය හරහා ගලායාමට හැකිවීමත් මීට හේතුවේ.
අයන ලෙසින් පවතින ද්රව්ය
සංස්කරණය| ස්ටොක් නාමය | සූත්රය | පැරණි ව්යවහාර නාමය |
|---|---|---|
| සරල කැටායන: | ||
| ඇලුමිනියම් | ||
| බේරියම් | ||
| බෙරිලියම් | ||
| සිසියම් | ||
| කැල්සියම් | ||
| ක්රෝමියම්(II) | ක්රෝමස් | |
| ක්රෝමියම්(III) | ක්රෝමික් | |
| ක්රෝමියම්(VI) | ක්රෝමයිල් | |
| කෝබෝල්ට්(II) | කෝබෝල්ටස් | |
| කෝබෝල්ට්(III) | කෝබෝල්ටික් | |
| කොපර්(I) | කියුප්රස් | |
| කොපර්(II) | කියුප්රික් | |
| කොපර්(III) | ||
| ගැලියම් | ||
| ගෝල්ඩ්(I) | ||
| ගෝල්ඩ්(II) | ||
| හීලියම් | (ඇල්ෆා අංශු) | |
| හයිඩ්රජන් | (ප්රෝටෝන) | |
| අයන්(II) | ෆෙරස් | |
| අයන්(III) | ෆෙරික් | |
| ලෙඩ්(II) | ප්ලම්බස් | |
| ලෙඩ්(IV) | ප්ලම්බික් | |
| ලිතියම් | ||
| මැග්නීසියම් | ||
| මැංගනීස්(II) | මැංගනස් | |
| මැංගනීස්(III) | මැංගනික් | |
| මැංගනීස්(IV) | මැංගනයිල් | |
| මැංගනීස්(VII) | ||
| මර්කරි(II) | ||
| නිකල්(II) | ||
| නිකල්(III) | ||
| පොටෑසියම් | ||
| සිල්වර් | ||
| සෝඩියම් | ||
| ස්ට්රොන්ටියම් | ||
| ටින්(II) | ස්ටැනස් | |
| ටින්(IV) | ස්ටැනික් | |
| සරල ඇනායන: | ||
| සල්ෆයිඩ් | ||
| ආසනයිඩ් | ||
| නයිට්රයිඩ් | ඒසයිඩ් | |
| බ්රෝමයිඩ් | ||
| ක්ලෝරයිඩ් | ||
| ෆ්ලුවොරයිඩ් | ||
| හයිඩ්රයිඩ් | ||
| අයඩයිඩ් | ||
| ඔක්සයිඩ් | ||
| පොස්පයිඩ් | ||
| ටෙලූරයිඩ් | ||
| ඔක්සො ඇනායන: | ||
| ආසනේට්(III) | ආසනයිට් | |
| ආසනේට්(V) | ආසනේට් | |
| බෝරේට් | ||
| බ්රෝමේට් | ||
| කාබනේට් | ||
| හයිඩ්රජන් කාබනේට් | බයිකාබනේට් | |
| ක්ලෝරේට්(I) | හයිපොක්ලෝරයිඩ් | |
| ක්ලෝරේට්(III) | ක්ලෝරයිට් | |
| ක්ලෝරේට්(V) | ක්ලෝරේට් | |
| ක්ලෝරේට්(VII) | ප'ක්ලෝරේට් | |
| ක්රෝමේට් | ||
| ඩයික්රෝමේට් | ||
| අයඩේට් | ||
| නයිට්රේට්(III) | නයිට්රයිට් | |
| නයිට්රේට්(V) | නයිට්රේට් | |
| පොස්පේට්(III) | පොස්පයිට් | |
| පොස්පේට්(V) | පොස්පේට් | |
| හයිඩ්රජන් පොස්පේට් | ||
| ඩයිහයිඩ්රජන් පොස්පේට් | ||
| මැංගනේට්(VI) | ප'මැංගනේට් | |
| සල්ෆේට්(VI) | ||
| හයිඩ්රජන් සල්ෆේට්(VI) | බයිසල්ෆේට් | |
| සල්ෆේට්(IV) | සල්ෆයිට් | |
| හයිඩ්රජන් සල්ෆේට්(IV) | බයිසල්ෆයිට් | |
| තයෝසල්ෆේට් | ||
| කාබනික අම්ල ඇනායන: | ||
| ඇසිටේට් | ||
| ෆෝමේට් | ||
| ඔක්සලේට් | ||
| හයිඩ්රජන් ඔක්සලේට් | බයොක්සලේට් | |
| බහු පරමාණුක කැටායන: | ||
| ඇමෝනියම් | ||
| හයිඩ්රෝනියම් | ||
| නයිට්රෝනියම් | ||
| මර්කරි(I) | ||
| බහු පරමාණුක ඇනායන: | ||
| හයිඩ්රජන් සල්ෆයිඩ් | බයිසල්ෆයිඩ් | |
| සයනේට් | ||
| තයෝසයනේට් | ||
| සයනයිඩ් | ||
| පෙරොක්සයිඩ් | ||


